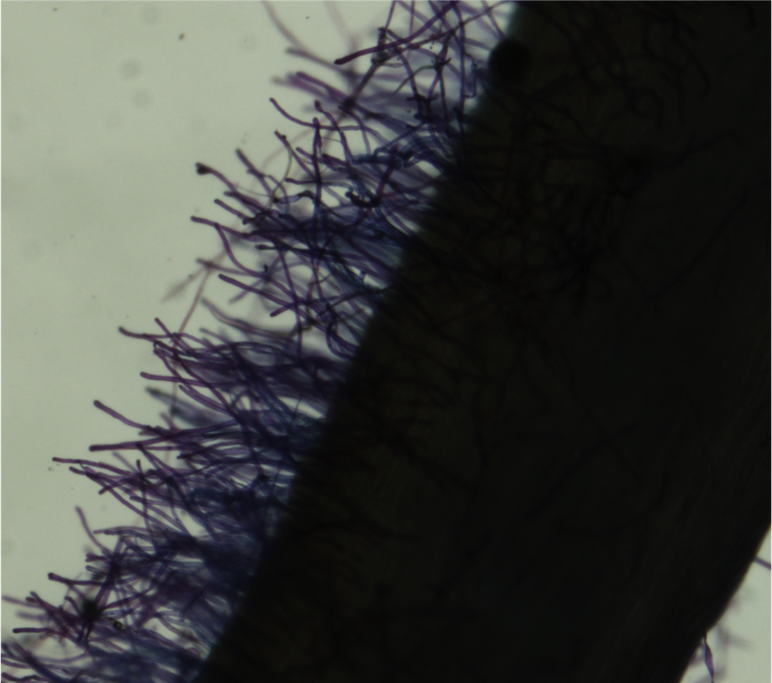
1. Ponha água deionizada num prato Petri e no segundo prato Petri ponha 0.05% da solução de Toluidine Blue dye. Usa uma pinça, para emerger a raíz na solucao de toluidine Blue dye por aproximadamente 5 segundos. Depois dos 5 segundos retire a raiz e passa água deionizada nela para diminuir a concentração da solução. Em seguida, ponha a raíz num prato Petri de 3" x 5". Adicione água deionizada até cobrir na totalidade a raiz. Leve o prato para um microscópio.
2. Use uma cámara digital microscopio (Nikon Digital Sight) conectada ao computador com o programa NIS Elements. Nos "settings da câmara", configure "Fast Focus" para 640x480 para aumentar a velocidade da câmara quando focada e configure "Quality capture" para 2560x1920 para maximizar a qualidade da captação da imagem. Selecione "scale", na qual irá ser necessária na dimensão da imagem no momento das análises no programa de ImageJ. Ajusta o magnificador para 2x. Usa as luzes flexíveis e as luzes bases do microscópio para melhor e necessária iluminação.
3. Para capturar uma imagem, click no botão "Auto" do programa NIS Elements. Sua imagem aparecerá por baixo da janela, e podera adicionar o nome da imagem.As imagens sao gravadas automaticamente num ficheiro (mesmo ficheiro). Estas deverao ser gravada no formato TIF. Deverá incluir no seu ficheiro a imagem do hemocitômetro que esta deverá ser a primeira a ser feita, no momento da calibragem do microscópio. A imagem do hemocitômetro serve de régua para ter a dimensão da imagem.
Análises da imagem
1. Baixe o programa free de análisis de imagem "ImageJ" do NIH website (http://rsbweb.nih.gov/ij/).
2. Abra a imagem da régua (hemocitômetro) que foi salva no formato TIF, para fazer a calibragem das imagens das raízes em conformidade com a calibragem da imagem da escala. Selecione ferramenta de linhas, Zoom in (pressione '+' e trace uma determinada distância na imagem, por exemplo 1 mm na régua. Use "Análise" e "Escala Definida", configure a distância conhecida e a unidade da distância (nesta casa a distância será de 1.00 e mm), selecione "Global" para salvar a configuração para todas as imagens e os resultados serão gravados na unidade escolhida.
3. Importa a sua pasta de imagens usando "Ficheiro", Importar, Imagens sequenciadas. Se tem muitas imagens, seleciona pilha virtual que será óptimo para maximizar a velocidade de importação de imagens. Se as imagens não abrem, vai para o editar, opções, Memória & Tópicos e aumente a memória alocada para a imageJ baseada no seu RAM do computador. O métodos mais simples e rápido será, abra uma imagem usando Ficheiro, Abrir, or Abrir a próxima.
4. Nas "Análise", "Medidas de configuracao", selecciona "Etiqueta de exibição" para incluir nome do ficheiro nos seus resultados de output.
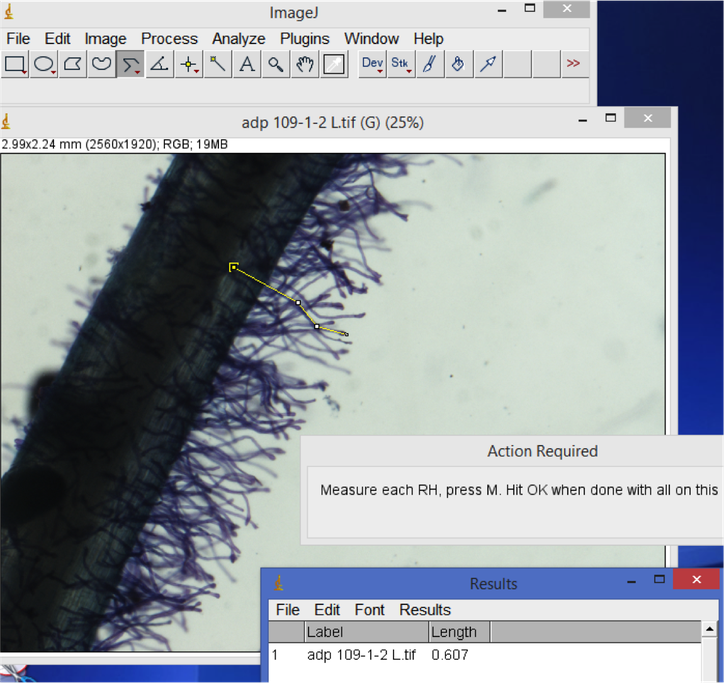
5. Comprimento de pelos radiculares
Abre uma imagem de pelos radiculares. Seleccione a ferramenta linha (click a directa para a "linha recta", linha segmentada, or freehand dependendo da sua preferência). Trace e meca o cumprimento dos pelos radiculares seleccionado. Click a letra "M" para salvar o resultado do comprimento medido no window e ao mesmo tempo estes resultados ficam gravados na folha de Excel.
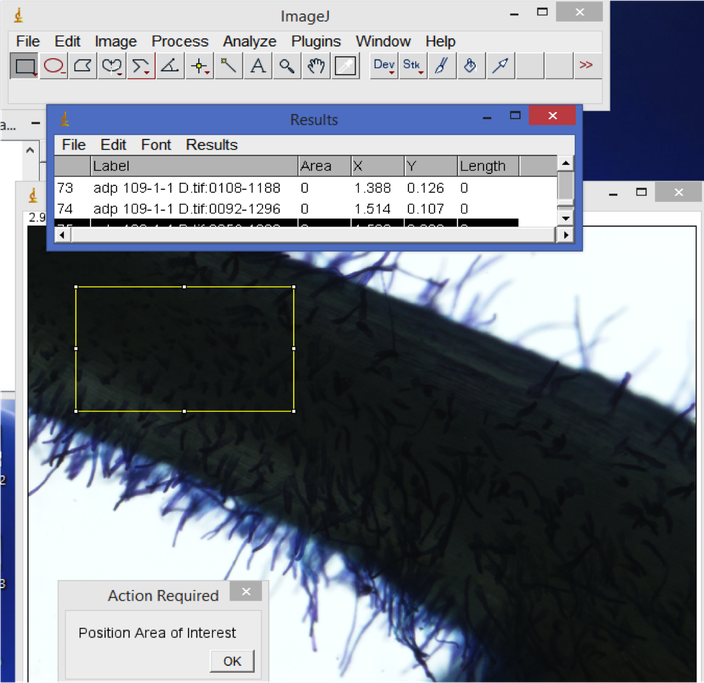
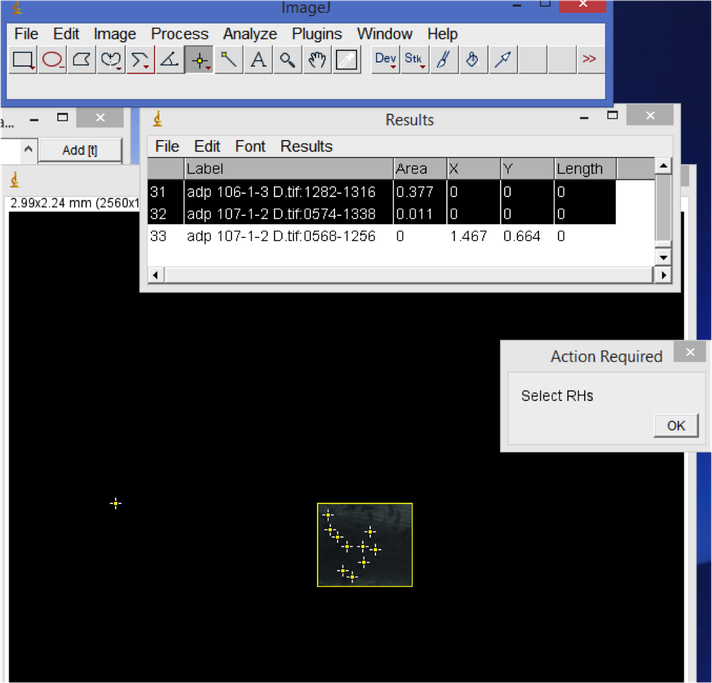
6. Densidade dos pelos radiculares
No programa ImageJ, abra uma imagem de pelos radiculares. Use a farremante de rectángulo e selecione uma área representativa da raiz. Seleccione pelos existentes dentro de rectángulo, depois clique na tecla "M" para salvar a área e o número de pêlos existentes naquela área. Os resultados serão automaticamente gravados na folha de Excel. Para calcular o número de pelos radiculares da raiz, divide a área dos pelos radiculares pelos números dos pelos e no final multiplica pela área da regua, os resultados deverão ser em mm^2.