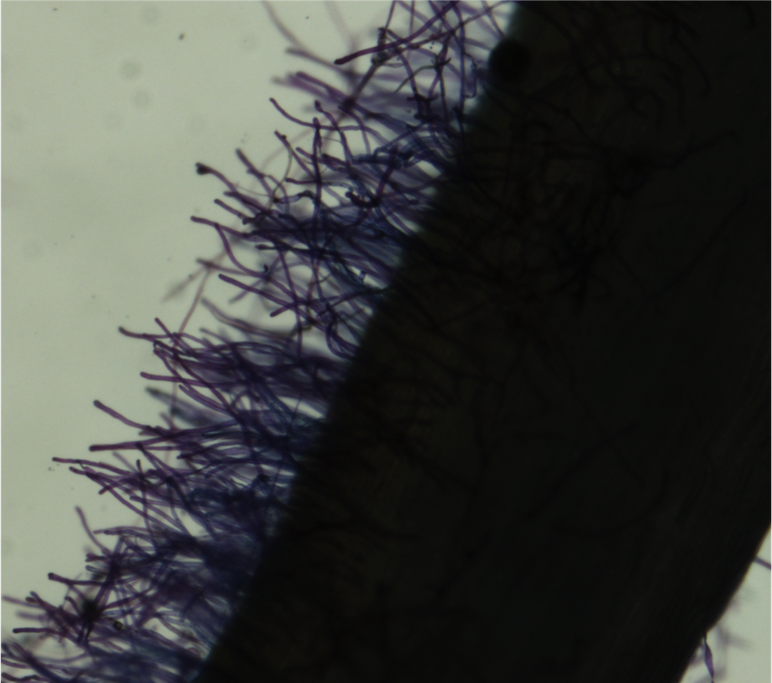
1. Llene una caja de Petri con agua desionizada, y otra caja con colorante azul de toluidina 0.05%. Usando pinzas, sumerja la raíz en el colorante azul por aproximadamente 5 segundos. Lave la raíz en el agua desionizada. Coloque la raíz en una caja de vidrio de 3"x 5". Agregue agua lentamente con una pipeta hasta que la raíz esté cubierta con el fin de suspender los pelos radicales. Ubique la caja con la raíz bajo un microscopio de disección ó estereoscopio.
2. Utilice un microscopio con cámara incorporada (Nikon Digital Sight) conectada a un computador que tenga instalado el software NIS Elements. En el programa, bajo "camera settings - configuración de cámara" elija "Fast Focus - foco rápido" en 640x480 para incrementar la velocidad de la cámara durante el enfoque, y configure "Quality (capture) - calidad de captura" en 2560x1920 para maximizar la calidad de captura de imagen. Seleccione la petaña "scale-escala", la cual se necesitará para escalar la imagen para posterior análisis de imagen en ImageJ. Ajuste la magnificación a 2x. Encienta las luces flexibles y las luces fijas de la base del microscopio para iluminar la muestra ubicada en la base del microscopio a medida que se vaya necesitando.
3. Para capturar la imagen, de click en el botón "Auto"(automático) en el software NIS Elements. La imagen aparecerá en la parte inferior de la ventana, and puede ser renombrada. Las imágenes se deberían poder guardar automáticamente en la misma carpeta. (Incluya una foto de un hematocitómetro o una regla con el fin de calibrar imágenes posteriormente).
Análisis de imagen
1. Descargue el software de análisis de imagen (gratuito) "ImageJ" del sitio en Internet (http://rsbweb.nih.gov/ij/).
2. Abra la imagen de calibración. Seleccione la herramienta de línea, magnifique la imagen (presione "+" y mantenga la barra espaciadora oprimida con el fin de mover la imagen con el indicador) y cuidadosamente trace una distancia conocida en la imagen, por ejemplo, 1 mm en la regla. Use "Analyze"(analizar) y "Set scale"(configure escala), indique la distancia conocida y sus unidades (en este caso sería 1.00 y mm), seleccione "Global"(global). Esto configurará la escala para todas sus imágenes de manera que el resultado estará en las unidades especificadas.
3. Importe su carpeta de imágenes usando "File"(archivo), "Import"(importar),"Image sequence"(sequencia de imágenes). Si tiene muchas imágenes, seleccione la opción "virtual stack" (pila virtual) con el fin de agilizar el proceso de importación. Si las imágenes no se pueden cargar, vaya a "Edit"(editar), "Options"(opciones), "Memory & Threads" (memoria e hilos), e incremente la memoria asignada a ImageJ basado en la memoria RAM de su computador. Alternativamente, abra cada imagen por separado usando "File"(archivo), "Open"(abrir), ú "Open Next"(abrir siguiente).
4. Bajo la opción "Analyze"(analizar), "Set Measurements…"(Configurar mediciones…), seleccione "Display label"(Mostrar etiqueta) para incluir un nombre de archivo en su resultado final.
5. Longitud de pelos radicales:
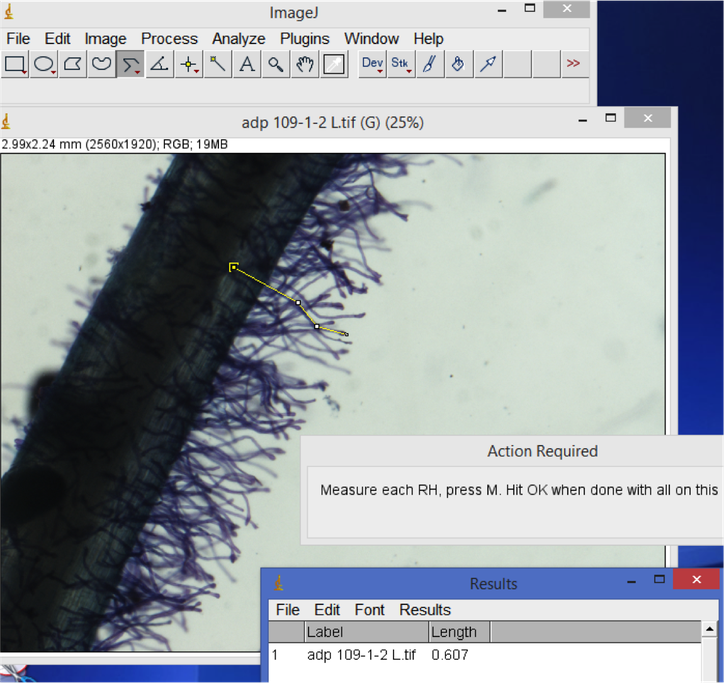
Abra su imagen de pelos radicales. Seleccione la herramienta línea (click derecho para "línea recta", "línea segmentada" or "mano alzada" según su preferencia- Trace y mida la longitud de los pelos radicales de interés. Oprima "M" para guardar la medición en la ventada de resultados. Cuando haya finalizado de medir todas las imágenes, no cierre las imágenes - guarde o copie la ventana de resultados y ábrala como un archivo delimitado con tabulaciones (tab-delimited) en Excel u otro programa de hojas de cálculo. Cree una nueva columna para el conteo de pelos radicales en su hoja de cálculo.
6. Densidad de pelos radicales:
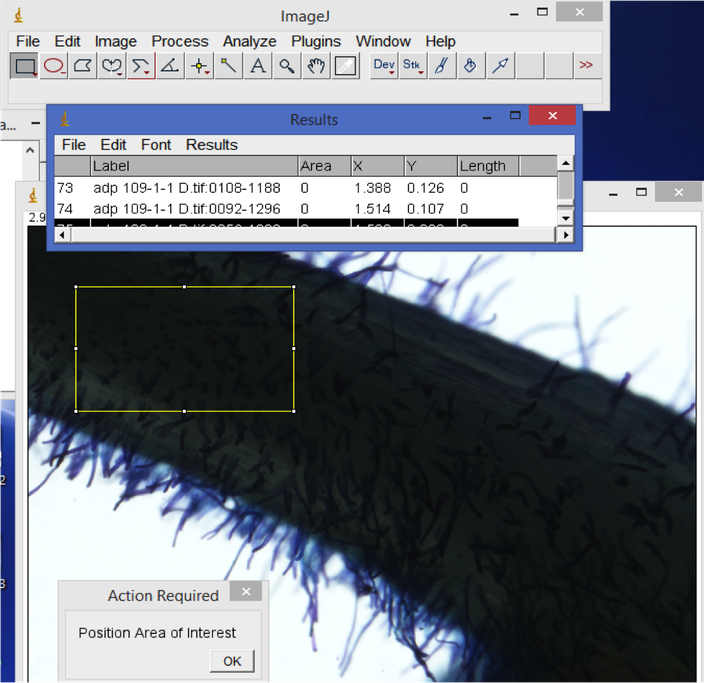
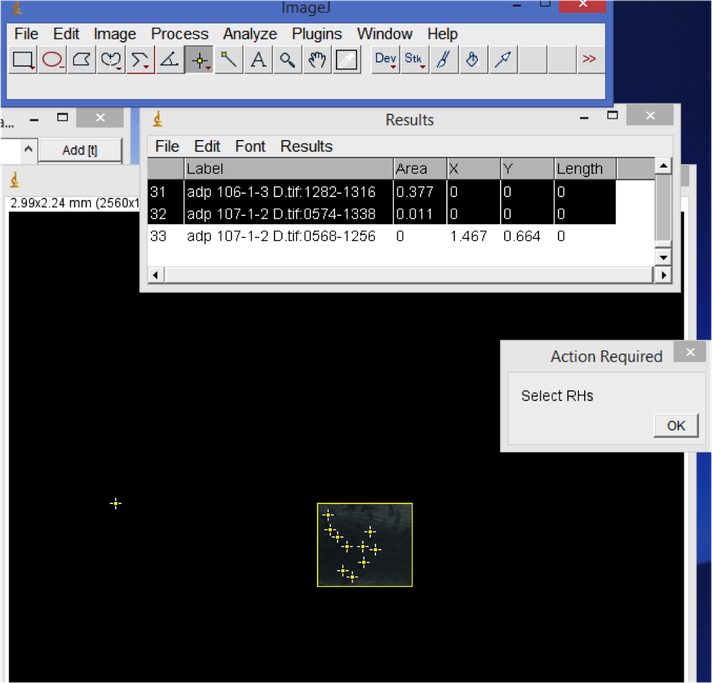
En ImageJ, comience con la primera imagen de raíces. Use la herramienta rectángulo para seleccionar un área representativa de la raíz. Oprima "M" para guardar el área. Después, visualmente cuente el número de pelos radicales en el área seleccionada. Registre este conteo en su hoja de cálculo. Cuando finalice con todas las imágenes, copie la ventana de resultados con los valores de áreas en la hoja de cálculo. Divida el conteo de pelos radicales en el área para calcular el número de pelos radicales por mm^2.